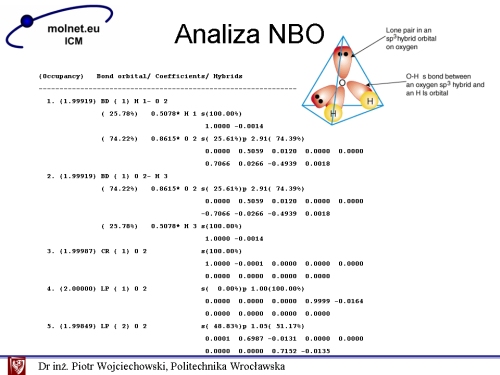
Dalsza część outputu zawiera szczegółową analizę NBO: Pierwszym w tabeli jest orbital wiążący σHO utworzony z orbitali atomowych pierwszego atomu wodoru i tlenu. Jest on zajęty przez 1,99919 elektronów. Tworzy się on w wyniku nakładania orbitalu 1s (100%) atomu wodoru i orbitalu atomu tlenu o hybrydyzacji sp2,91: σHO = 0,5078 (s)H + 0,8615 (sp2,91)O Orbital s na atomie wodoru ma oczywiście w 100% charakter s, natomiast hybryd sp2,91 na atomie tlenu ma w 25,61% charakter s i 74,39% charakter p. („Idealna” hybrydyzacja sp3 ma w 75% charakter p). Liczby 0,5078 oraz 0,8615 nazywane są współczynnikami polaryzacji i określają one wpływ poszczególnych hybrydów na tworzące się wiązanie. Orbital sp2,91 atomu tlenu ma większy udział procentowy (74,22%) w tworzeniu wiązania σ NBO. Atom tlenu posiada większy współczynnik polaryzacji (0,8615), ponieważ jest bardziej elektroujemny od wodoru. Podobnie możemy opisać drugi orbital wiążący σHO utworzony z orbitali atomowych tlenu i „ostatniego” atomu wodoru. Orbital oznaczony numerem 3 w całości utworzony jest przez orbital 1s o centrum znajdującym się w środku masy atomu tlenu. Dwa orbitale, oznaczone numerami 4 i 5, opisują orbitale wolnych par elektronowych: pierwszy orbital w pełni obsadzony (2.0000e) jest czystym orbitalem typu p. Natomiast drugi o ładunku 1,99849e posiada hybrydyzację sp1,05, bardzo bliską „wyidealizowanej” hybrydyzacji dygonalnej sp.