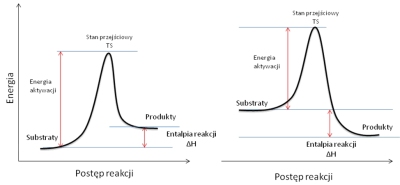
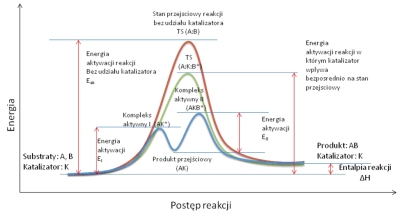
Na drodze od substratów do produktów (lub produktu pośredniego) tworzy się stan przejściowy (ang. Transition State, w skrócie TS). Stan przejściowy jest to taki kompleks, który posiada wyższą energię od substratów i produktów (maksimum energetyczne na drodze reakcji). Charakteryzuje się on zmianą energii oddziaływań poszczególnych atomów oraz częściowym przegrupowaniem, które ostatecznie prowadzi do produktów reakcji. Jest to w pewnym sensie stan pośredni pomiędzy substratami i produktami. Substraty, zanim ulegną reakcji muszą osiągnąć energie wewnętrzna, równą energii stanu przejściowego niezależnie od energii produktów. Różnica pomiędzy energią substratów i energią stanu przejściowego nazywana jest energią aktywacji (Ea). Wielkość różnicy tej energii decyduje o kinetyce reakcji i czasami ze względu jej wysoką wartość reakcja praktycznie nie zachodzi. Reakcja może zachodzić poprzez kilka stanów przejściowych i produktów przejściowych. Wówczas największy wpływ na szybkość całej reakcji ma najwolniejszy etap – czyli etap o największej energii aktywacji. Różnica energii produktów i substratów, która nie zależy od drogi reakcji, czyli tym samym nie zależy od energii aktywacji, decyduje o termodynamice układu, czyli równowadze, jakie osiągnie układ po wystarczająco długim czasie i nazywana jest energią reakcji. Jeśli energia ta jest niższa, to reakcja jest endotermiczna, jeśli jest natomiast wyższa, to reakcja jest reakcją egzotermiczną.
W obliczeniach teoretycznych stan przejściowy powinien cechować się jedną częstością urojoną (o znaku minusowym) zgodną ze współrzędną reakcji. To znaczy, jeżeli mamy reakcje rozerwania wiązania, to drganie to powinno zachodzić wzdłuż wiązania rozrywanego.