- obliczania energii stanów przejściowych reakcji bądź zmiany konformacji
- szukania konformerów o najniższej energii, badanie minimów energetycznych – określanie typu oraz ilości minimów energetycznych
- wytłumaczenia niektórych badań spektroskopowych
- PES jest przydatne w badaniach dynamiki układów, termodynamiki
- prezentacji wyników obliczeniowych
W niektórych obliczeniach musimy wyznaczyć zmiany energii potencjalnej podczas zmiany jednego z parametrów geometrycznych, na przykład zmiana długości wiązania bądź kąta dwuściennego. Możemy tą metodą szukać minimów energetycznych, szacować energie stanów i produktów przejściowych. Jednym z najprostszych przykładów jest rozrywanie wiązania czy rotacja grupy (zmiana kąta dwuściennego o 360°) w cząsteczce. Obliczenia te możemy przeprowadzić dla układów, w którym ulega zmianie jedynie jeden parametr, czyli w naszym przypadku kąt dwuścienny – wówczas proces ten nazywamy skanem bez relaksacji cząsteczki. Wykonujemy, to nadając poszczególne wartości badanego kąta i obliczamy energie układu. Drugim sposobem jest zmiana jednego z parametrów oraz zamrażanie go, a następnie optymalizacja pozostałych parametrów geometrycznych cząsteczki. Popularnie nazywamy taką procedurą skan z relaksacją. Sposób ten wymaga więcej czasu obliczeniowego procesora, jednak daje wyniki bardziej zbliżone do rzeczywistych. Przykład takich obliczeń wykonaliśmy dla cząsteczki CH3CH2SH[1].
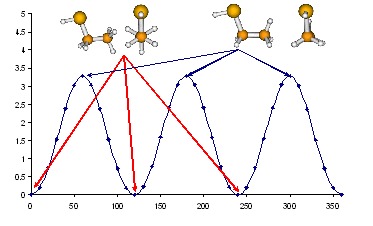
Wykres przedstawiający zmianę energii [kcal/mol] w zależności od kąta dwuściennego S–C–C–H obliczony B3LYP/6-31G(d)
Na tym wykresie bardzo łatwo jest znaleźć minimum globalne, bądź określić energię rotacji. Niejednokrotnie wartość energii na początku i na końcu wykresu po obrocie o 360° różni się w niewielkim stopniu. Różnica ta wynika ze względu na algorytmy optymalizacyjne, otrzymana struktura końcowa zależy od punktu startowego. Początkowy i końcowy punkt na wykresie odpowiada strukturom obliczonym dla różnych punktów startowych. Różnica jest tym większa, im bardziej labilna jest cząsteczka. Aby końce wykresu dokładnie pokrywały się, należy sporządzić go z większej ilości punktów i odrzucić kilka punktów początkowych. Skan możemy robić także dla dwóch lub więcej zmiennych, wówczas uzyskujemy mapę energii potencjalnej PES (ang. Potential Energy Surface), umożliwiającą znalezienie wszystkich minimów energetycznych dla małych cząsteczek. Przykład takich badań znajduje się poniżej dla H-fosfonianu etylowego.
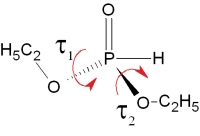
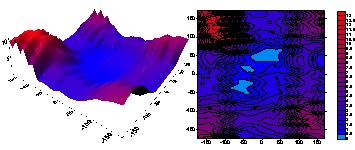
Wykres oraz poziomica zmian energii [kcal/mol] H-fosfonianu dietylowego w zależności od zmiany kątów dwuściennych τ1(O=P–O–C) i τ2(O=P–O–C’) [°]. Wykres został wykonany z 650 punktów odpowiadającym zoptymalizowanym konformerom z zamrożonymi wymienionymi kątami dwuściennymi. Punkty zostały połączone powierzchnią. Zmiana kąta była prowadzona co 15 stopni, obliczenia B3LYP/6-31G(d).
Energia tej cząsteczki zależy w głównej mierze od ułożenia kątów dwuściennych τ1(O=P–O–C) i τ2(O=P–O–C’). Ze względu na symetrię H-fosfonianu dietylowego obliczenia energii podczas zmiany kątów dwuściennych tworzą płaszczyznę także w pewnym sensie symetryczną. Widzimy na tej płaszczyźnie jedno minimum globalne odpowiadające dwóm minimom energetycznym (konformery w tych minimach są lustrzanymi odbiciami nakładającymi się na siebie) i jedno maksimum globalne, w którym grupy etylowe leżą blisko siebie. Maksimum to leży na jednym z rogów wykresu. Podczas sporządzania takich wykresów należy pamiętać, że najwięcej informacji niesie różnica energii między najniższym, a badanym punktem, nie zaś obliczona bezpośrednio energia cząsteczki, która zależy od sposobu przeprowadzenia obliczeń.
Wykresy te pozwalają na znalezienie stanów przejściowych rotacji, przegrupowania wewnątrz cząsteczki, czy poszczególnych etapów reakcji. Na wykresie (powierzchni) energii potencjalnej punkty w maksimum mogą odpowiadać stanom przejściowym. Takie szukanie stanów przejściowych jest procesem, który „z grubsza” określa to, co dzieję się w układzie. Prawidłowe znalezienie stanu przejściowego powinno być potwierdzone obliczeniami częstości.
[1] Etanotiol jest uważany za jeden z najbardziej śmierdzących związków (Guinness Book Of WorldRecords 2000). Jego wykrywalność dla człowieka wynosi około 0.0000087 ppm to jest około jednej części na 3 biliony części powietrza. Właściwość ta znalazła zastosowanie tej grupy związków (tiole) do nawonnienia gazów palnych dostarczanych do kuchenek gazowych.