Jednym z trudniejszych problemów, które napotykamy w prezentacji danych jest odpowiednia wizualizacja obliczeń. Powyżej obliczenia zostały przeprowadzone dla cząsteczki H2O2. Powyżej została również zamieszczona prezentacja ukazująca, w którym miejscu pliku wynikowego można znaleźć informację o wartości parametru geometrycznego i energii odpowiadającej danemu krokowi w obliczeniach PES. Wizualizację tych danych można dokonać dowolnym programem (Microsoft Excel, Gnuplot, OpenOffice Calc itp.), jedyny problem napotykamy z odpowiednim przygotowaniem danych, aby uzyskać kolumny ze zmiennymi geometrycznymi oraz energią. Wykonuje się to przez odpowiednie wczytanie linii z pliku oraz podział. Dla początkujących polecam: (1) skopiowanie fragmentu pliku do notatnika, (2) zapisanie go jako txt, (3) otworzenie w arkuszu kalkulacyjnym z podziałem linii na fragmenty, (4) ręczne posortowanie danych. Jeżeli punktów jest dużo wówczas praktycznym usprawnieniem jest napisanie własnego skryptu. Inną opcją jest skorzystanie z programów graficznych. Program Molden niestety nie generuje wykresów PES. Można jedynie zobaczyć drogę optymalizacji. Dla cząsteczki bardziej skomplikowanej – CH3CH2SH wykres drogi optymalizacji będzie wyglądał następująco:

Pierwszy wykres przypomina powierzchnię energii potencjalnej sporządzonej dla CH3CH2SH, ale jest bardziej „poszarpany”. Program Molden wyświetla wszystkie punkty pośrednie optymalizujące poszczególne etapy, dlatego wykres ma taki kształt. Innym programem wartym wspomnienia jest komercyjny program GaussView. Dla naszego przykładu wykres naszych kroków optymalizacji będzie wygląda następująco:
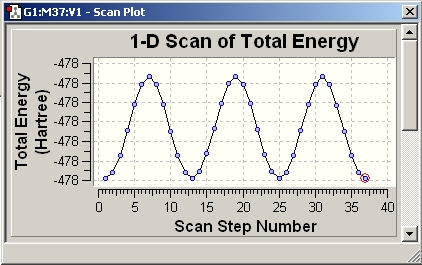
Wykres ten jest o wiele lepszy niż wykres wykonany za pomocą programu Molden, niestety program GaussView jest komercyjny. Sposób przygotowania oraz wyświetlania przez Gaussview znajduje się na stronach molent.eu. Nowa wersja programu GaussView potrafi rysować wykresy 3-wymiarowe.