- obliczania energii stanów przejściowych reakcji bądź zmiany konformacji
- szukania konformerów o najniższej energii, badanie minimów energetycznych – określanie typu oraz ilości minimów energetycznych
- wytłumaczenia niektórych badań spektroskopowych
- PES jest przydatne w badaniach dynamiki układów, termodynamiki
- prezentacji wyników obliczeniowych
Poniżej znajdują się wszystkie zagadnienia z modelowania molekularnego obejmujące problemy chemii obliczeniowej, spektroskopii, katalizy. Informacje nie są usystematyzowane, możesz przeszukać je, przeglądając artykuły. Materiały te powstały podczas Praktycznych szkół Modelowania Molekularnego i są oferowane nie odpłatnie. Jeżeli chcesz, dostępne są dwie książki do pobrania w naszym innym serwisie rozwijanym z pasji do popularyzacji wiedzy i chęci przekazania tej pasji dzieciom.
Obliczanie energii oddziaływania
Pierwszym etapem obliczeń energii oraz sposobów oddziaływania jest optymalizacja kompleksu cząsteczek. Należy tak zbudować cząsteczki i tak ustawić je koło siebie, żeby jak najlepiej odzwierciedlały możliwe oddziaływania. Następnie taki układ poddajemy procesowi optymalizacji. Czasami do końca nie wiemy, w którym miejscu następuje oddziaływanie wówczas próbujemy różnych sposobów.
Jeżeli otrzymaliśmy zoptymalizowany kompleks dwóch cząsteczek, wówczas przystępujemy do analizy wiązań wodorowych (odległości, kąty) lub do klasyfikacji występujących oddziaływań. Tą analizę opieramy na strukturze kompleksu. Jednym z ważniejszych parametrów są obliczenia energii. Załóżmy, że nasz kompleks składa się z dwóch fragmentów: A i B. Jeżeli znamy energie zoptymalizowanych osobno fragmentów A i B oraz energię kompleksu, wówczas możemy obliczyć energię dysocjacji kompleksu. Liczona jest ona jako różnica energii kompleksu AB i osobno fragmentów A i B. Można to wyrazić wzorem:
ΔEdysocjacji = EAB – EA’ – EB'

Pierwszy wykres przypomina powierzchnię energii potencjalnej sporządzonej dla CH3CH2SH, ale jest bardziej „poszarpany”. Program Molden wyświetla wszystkie punkty pośrednie optymalizujące poszczególne etapy, dlatego wykres ma taki kształt. Innym programem wartym wspomnienia jest komercyjny program GaussView. Dla naszego przykładu wykres naszych kroków optymalizacji będzie wygląda następująco:
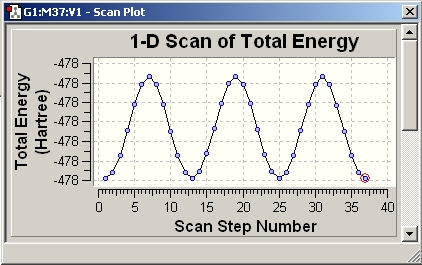
Wykres ten jest o wiele lepszy niż wykres wykonany za pomocą programu Molden, niestety program GaussView jest komercyjny. Sposób przygotowania oraz wyświetlania przez Gaussview znajduje się na stronach molent.eu. Nowa wersja programu GaussView potrafi rysować wykresy 3-wymiarowe.
Produkty pośrednie
Produkt pośredni reakcji (ang. Reaction Intermediate, intermediate) jest to okreslony stan cząsteczkowy, który występuje na drodze reakcji chemicznej. Cechuje się on określonym czasem istnienia. Czasami produkty dają się wyodrębnić, bądź badać spektroskopowo np:. NMR, IR. Produkt pośredni często bywa kompleksem dwóch cząsteczek, „które niejako przygotowują się do reakcji”. W obliczeniach teoretycznych częstości drgań stanu pośredniego nie powinny być wartościami ujemnymi.
Czytaj więcej: Mechanizm Reakcji - Produkty pośrednie, katalizatory
Na drodze od substratów do produktów (lub produktu pośredniego) tworzy się stan przejściowy (ang. Transition State, w skrócie TS). Stan przejściowy jest to taki kompleks, który posiada wyższą energię od substratów i produktów (maksimum energetyczne na drodze reakcji). Charakteryzuje się on zmianą energii oddziaływań poszczególnych atomów oraz częściowym przegrupowaniem, które ostatecznie prowadzi do produktów reakcji. Jest to w pewnym sensie stan pośredni pomiędzy substratami i produktami. Substraty, zanim ulegną reakcji muszą osiągnąć energie wewnętrzna, równą energii stanu przejściowego niezależnie od energii produktów. Różnica pomiędzy energią substratów i energią stanu przejściowego nazywana jest energią aktywacji (Ea). Wielkość różnicy tej energii decyduje o kinetyce reakcji i czasami ze względu jej wysoką wartość reakcja praktycznie nie zachodzi. Reakcja może zachodzić poprzez kilka stanów przejściowych i produktów przejściowych. Wówczas największy wpływ na szybkość całej reakcji ma najwolniejszy etap – czyli etap o największej energii aktywacji. Różnica energii produktów i substratów, która nie zależy od drogi reakcji, czyli tym samym nie zależy od energii aktywacji, decyduje o termodynamice układu, czyli równowadze, jakie osiągnie układ po wystarczająco długim czasie i nazywana jest energią reakcji. Jeśli energia ta jest niższa, to reakcja jest endotermiczna, jeśli jest natomiast wyższa, to reakcja jest reakcją egzotermiczną.
- Jak liczymy mechanizmy reakcji chemicznych
- Rozkład ładunku na cząsteczce (Mulliken, Chelp) na przykładzie kationu allilowego - lektor
- NBO - 2009
- Modelowanie
- Polityka Prywatności
- Historia molnet
- Zwariowane kartki chemika na walentynki
- Witaminy A, B2, B5 -wizualizacja w ACDlabs
- Struktura zabawnych związków chemicznych
- Nanoludziki
- Chinina
- Biopaliwa
- Galeria - Barwniki spożywcze (E....)
- GaussSum
- Przygotowanie pierwszego pliku z obliczeniami